Para estudar química para o Enem, é fundamental entender a diferença entre substância e mistura.
Substância é um material que apresenta propriedades físicas definidas, determinadas e praticamente invariáveis nas mesmas condições de pressão e temperatura. As substâncias são puras quando a molécula é formada por apenas um tipo de elemento químico. Ex: O2. As substâncias são compostas quando a molécula é formada por mais de um tipo de elemento químico. Ex: H2O.
Mistura é um material composto com mais de uma substância e cujas propriedades físicas variam nas mesmas condições de pressão e temperatura. As misturas podem homogêneas (formam uma fase só) ou heterogêneas (formam mais do que uma fase). No caso de uma mistura, há técnicas de separação das substâncias que a constituem. E é isso que veremos a partir da análise de uma questão de química que caiu no Enem de 2014.
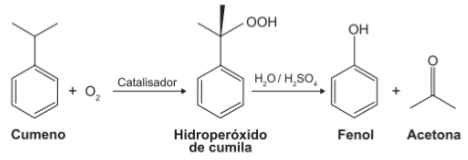
Enem 2014 – Caderno Amarelo – Questão 68O principal processo industrial utilizado na produção de fenol é a oxidação do cumeno (isopropilbenzeno). A equação mostra que esse processo envolve a formação do hidroperóxido de cumila, que em seguida é decomposto em fenol e acetona, ambos usados na indústria química como precursores de moléculas mais complexas. Após o processo de síntese, esses dois insumos devem ser separados para comercialização individual.Considerando as características físico-químicas dos dois insumos formados, o método utilizado para a separação da mistura, em escala industrial, é aa) filtração.
b) ventilação.
c) decantação.
d) evaporação.
e) destilação fracionada.
RESOLUÇÃO E COMENTÁRIOSAlternativa EQuando o enunciado diz: “Considerando as características físico-químicas dos dois insumos…” ele está se referindo a ambos estarem no estado líquido à temperatura ambiente e também serem de cadeias polares, isto é, são solúveis entre si. Nossa tarefa consiste, portanto, em separar duas substâncias líquidas e que estão dissolvidas formando uma mistura homogênea. Vamos analisar os processos sugeridos e lembrar em quais ocasiões devemos usá-los:
- Filtração: geralmente utilizado para separar misturas heterogêneas entre líquidos e sólidos. Ao fazermos café, por exemplo, misturamos o pó com a água formando uma solução heterogênea. As partículas do café que não se dissolveram, ao passar pelo filtro, ficam retidas nele enquanto que a mistura (água mais partículas solúveis do café) passou através dele.
- Ventilação: utilizada para separar substâncias sólidas que apresentam diferenças significativas de densidade entre seus componentes. Por exemplo, ao torrarmos amendoim, se quisermos separar a casca lançamos uma corrente de ar (como um assopro). A casca do amendoim, sendo mais leve do que ele, será levada enquanto que o amendoim mais pesado permanecerá.
- Decantação: utilizamos a decantação para separar, assim como na filtração, misturas heterogêneas entre líquidos e sólidos, mas também entre líquidos. Aqui as substâncias que compõem a mistura devem apresentar diferenças de densidade entre as fases. A fase mais densa tende a ocupar a posição mais inferior do reservatório enquanto que a fase menos densa tende a ocupar a posição mais superior. Exemplos do uso de decantação é a limpeza de piscinas onde as partículas mais densas, após algum tempo de repouso, depositam-se no fundo; ou um frasco contendo água e óleo, onde o último, por ser menos denso, ocupa a parte de cima do frasco.
- Evaporação: em soluções homogêneas entre sólido e líquido, para separar o soluto (sólido) do solvente (líquido) utiliza-se, quando não há interesse imediato, a evaporação. Em salinas, a água do mar é acondicionada em tanques largos e rasos sob a luz do sol. A água é evaporada lentamente e ao final do processo resta apenas o sal depositado no fundo. Uma desvantagem nítida é a perda de um dos componentes, no caso a água.
- Destilação fracionada: utiliza-se a destilação fracionada para separar misturas homogêneas formadas por duas ou mais substâncias que oferecem certa dificuldade para a sua separação. Devido à diferença entre os pontos de ebulição das substâncias envolvidas é possível separá-las utilizando instrumentos adequados. À medida que os líquidos vão atingindo seus pontos de ebulição, em ordem crescente, ao passarem pelo condensador, tornam-se líquidos novamente. Assim um a um eles vão sendo separados em diferentes frascos ou reservatórios.
No caso da nossa mistura, o melhor método para separá-las é a destilação fracionada. A acetona é retirada do sistema primeiro porque é mais volátil, e pode ser recuperada, sobrando apenas o fenol que é menos volátil. Portanto, esta é a alternativa correta.Comentário: Por se tratar de duas substâncias orgânicas, é possível que os elaboradores da questão tenham feito uma alusão ao processo de destilação fracionada do petróleo, um dos exemplos mais clássicos desse tipo. A questão avalia o entendimento do aluno em relação aos processos de separação entre misturas e em quais situações eles são utilizados.Conteúdos envolvidos: Análise imediata (separação de misturas).
Nenhum comentário:
Postar um comentário